Нейрохирургическое лечение болезни Паркинсона
Нейрохирургическое лечение болезни Паркинсона
Е.В.Бриль[1], А.А.Томский[2], Н.В.Федорова[1], В.А.Шабалов[2], А.А.Гамалея[1]
С 1950-х годов нейрохирургические стереотаксические деструкции (таламотомии, паллидотомии) были одним из основных методов коррекции наиболее существенных проявлений болезни Паркинсона (БП) — тремора, ригидности, брадикинезии, хотя часто приводили к серьезным осложнениям, таким как параличи. К 1969 г. в мировой печати были опубликованы результаты почти 40 000 стереотаксических операций [2,4]. После внедрения леводопы в клиническую практику начиная с 1967 г. количество стереотаксических деструкций значительно уменьшается. Однако по мере накопления опыта фармакотерапии БП возникли новые проблемы: лекарственные дискинезии и моторные флуктуации, поиски коррекции которых привели к своего рода «ренессансу» хирургического лечения БП, но уже на новом технологическом уровне.
Несмотря на то что положительное влияние нейростимуляции таламуса на тремор было известно давно, идея использования ее в терапевтических целях возникла только в 1987 г., когда французский нейрохирург A.Benabid опубликовал сообщение о результатах стимуляции вентрального промежуточного ядра таламуса (VIM) [6]. В 1992 г. L.V.Laitinen предложил использовать вместо паллидотомии (деструкции внутреннего сегмента бледного шара — GPI) стимуляцию этой структуры, сообщив, что нейростимуляция GPI вызывает уменьшение брадикинезии, ригидности, а также лекарственных дискинезий [12]. Стимуляция субталамического ядра (STN) для лечения БП была впервые выполнена в 1994 г. в Гренобле A.Benabid и соавт. [7].
Таким образом, с момента первого использования нейростимуляции глубинных структур головного мозга прошло уже более 20 лет. За это время проведено свыше 60 000 операций, и нейростимуляция подкорковых структур перешла из разряда экспериментальных методов в рутинные.
Стереотаксические деструкции (таламотомия, паллидотомия) продолжают выполняться в некоторых клиниках, однако в настоящее время в функциональной нейрохирургии наметилась тенденция к переходу к менее травматичной нейростимуляции. Деструктивные операции в настоящее время возможны только у больных с относительно изолированным, преимущественно односторонним тремором, а также в случаях, когда имеются противопоказания к стимуляции глубинных структур мозга (например, при высоком риске инфицирования) или когда стимуляция недостаточно эффективна.
В силу большей безопасности, отсутствия риска необратимого повреждения головного мозга, возможности двустороннего воздействия высокочастотная стимуляция глубинных структур мозга в последние годы стала предпочтительным вариантом нейрохирургического вмешательства.
Следует отметить, что пациентам, которым была выполнена паллидотомия, при снижении ее эффекта не исключается проведение нейростимуляции STN [13], а больных после таламотомии можно в последующем лечить нейростимуляцией STN либо GPI.
Система для нейростимуляции состоит из трех имплантируемых компонентов: четырехконтактного электрода, нейростимулятора и провода, соединяющего электрод с нейростимулятором (рис. 1). Методика операции заключается в имплантации в головной мозг с двух сторон электродов, которые соединяют с нейростимулятором, имплантируемым подкожно в подключичную область. Генератор импульсов представляет собой электрон-
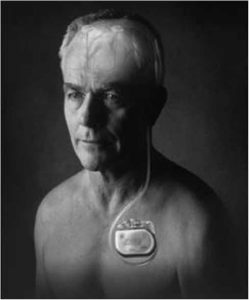 Рис. 1. Внешний вид нейростимулятора KINETRA™
Рис. 1. Внешний вид нейростимулятора KINETRA™
(Medtronic).
ную микросхему для регулируемой генерации импульсов и батарею (в неперезаряжаемых моделях) либо аккумулятор (в перезаряжаемых моделях). Неперезаряжаемые стимуляторы имеют срок действия от 2 до 5 лет, после чего их необходимо заменить; достоинством перезаряжаемых стимуляторов является более длительный срок службы (примерно 9 лет), недостатком — необходимость регулярной подзарядки (несколько раз в неделю) [1].
Мишенями для нейростимуляции в настоящее время чаще всего служат STN, GPI и VIM. Точный механизм нейростимуляции до сих пор неизвестен, однако полагают, что высокочастотная стимуляция блокирует патологическую активность STN и GPI [5].
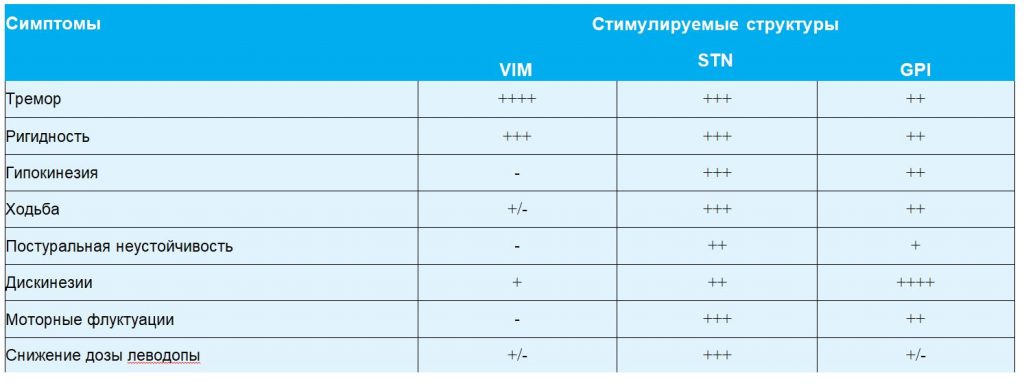
Воздействие на эти мишени по-разному влияет на основные симптомы БП (табл. 1). Выбор оптимальной точки мишени у каждого пациента осуществляется в специализированном центре совместно неврологом и нейрохирургом.
Стимуляция STN позволяет ослабить все основные двигательные проявления БП (тремор, ригидность, гипокинезию); сократить продолжительность и уменьшить тяжесть периода «выключения» (при оценке по III части шкалы UPDRS) на 45-65%, уменьшить выраженность лекарственных дискинезий на 67-83%, а также снизить дозу дофаминергических средств, прежде всего леводопы, в среднем на 50% [9, 14].
Стимуляция GPI наиболее эффективна при медикаментозных дискинезиях, которые уменьшаются на 66-90%. Однако влияние стимуляции GPI на тяжесть основных двигательных симптомов менее выражено (30-50%), и снизить дозу дофаминергических средств в такой степени, как при стимуляции STN не удается; кроме того, при длительном катамнестическом исследовании эффект стимуляции GPI не столь выражен, как при стимуляции STN [9, 14].
Стимуляция VIM показана больным с преимущественно дрожательной формой БП, поскольку уменьшает тремор на 90%, незначительно снижает ригидность и не влияет на остальные симптомы БП [16].
Успех нейрохирургического вмешательства определяется многими факторами, главными из которых являются правильный отбор больных, точно выполненная имплантация электродов, отсутствие интра- и послеоперационных осложнений, адекватно подобранная программа нейростимуляции, а также оптимальное ведение больных в отдаленные сроки, включающее коррекцию программы нейростимуляции и коррекцию фармакотерапии при прогрессировании заболевания.
Необходим комплексный индивидуальный подход к отбору больных, учитывающий не только показания и противопоказания к операции, но и большое количество других факторов, таких как возраст больного, длительность заболевания, скорость прогрессирования болезни, наличие или отсутствие немоторных симптомов.
Таблица 1 Эффекты, достигаемые при стимуляции глубинных структур мозга у больных БП
выраженные моторные флуктуации или дискинезии, не корригируемые оптимальной консервативной терапией, в том числе адекватной дозой дофаминергических средств;
Показаниями для выполнения нейрохирургического вмешательства больным с диагнозом БП (другие нозологические формы паркинсонизма должны быть исключены) являются:
плохая переносимость препаратов леводопы, не дающая возможности повысить ее дозу до оптимального уровня (прежде всего из-за дискинезий «пика дозы»); выраженный инвалидизирующий тремор покоя, который не удается корригировать с помощью медикаментозной терапии.
При отборе больных строго соблюдаются следующие критерии:
длительность заболевания не менее 5 лет; стадия заболевания по Хен-Яру не ниже 3-й; высокая эффективность леводопы при проведении фармакологической пробы;
высокая степень повседневной активности (не менее 60-70% по шкале Шваба-Ингланда) в периоде «включения».
Всем пациентам проводится однократная фармакологическая проба с назначением индивидуальной эффективной дозы леводопы в утренние часы после 12-часового ночного перерыва в приеме препарата. Сравнивают показатели по шкале UPDRS (учитывают суммарную оценку по II и III частям этой шкалы) в периодах «включения» и «выключения». Эффект леводопы оценивается как достаточно высокий, если разница показателей составляет 50%.
Как правило, оперативное вмешательство выполняют пациентам до 75 лет. По данным некоторых исследований, нейростимуляция STN у пожилых пациентов менее эффективна, чему относительно молодых [8, 17]. Кроме того, в более старшем возрасте чаще встречаются когнитивные нарушения, постуральные расстройства, а также сопутствующая соматическая патология, которые не дают проявиться положительному эффекту операции.
Важным условием направления на оперативное вмешательство служит отсутствие выраженных когнитивных или аффективных расстройств, в частности глубокой депрессии с суицидальными мыслями. Противопоказаниями к оперативному лечению являются также острый психоз, алкогольная и наркотическая зависимость, выраженная церебральная атрофия или очаговые поражения мозга (по данным МРТ), а также коагулопатия, сахарный диабет, иммуносупрессия, прием антикоагулянтов.
Нейрохирургическое вмешательство позволяет ослабить дискинезии и тремор, уменьшить клинические проявления в период «выключения». Однако оно не позволяет отказаться от лекарственной терапии, хотя создает условия для ее оптимизации. Кроме того, после оперативного вмешательства обычно не устраняются симптомы (например, нарушения ходьбы), которые сохраняются в период «включения».
Результаты хирургического лечения во многом зависят также от подбора программы стимуляции. Неадекватно подобранная программа электростимуляции способна не только свести к минимуму результаты операции, но и ухудшить клинические проявления заболевания [7, 12]. Программирование нейростимулятора производится неинвазивно с помощью специального программатора и требует от специалиста знания электроанатомии глубоких структур мозга. Цель программирования — найти наиболее эффективный электродный контакт, стимуляция которого обеспечивает максимальный клинический эффект при минимальных проявлениях побочных эффектов [1], для этого используются различные режимы стимуляции (монополярный, биполярный), а также различные значения параметров электростимуляции (амплитуды, длительности и частоты импульса).
Параллельно подбору параметров электростимуляции проводится коррекция медикаментозного лечения. Подбор терапии осуществляется эмпирически и зависит от степени клинического улучшения на фоне нейростимуляции. Нейростимуляция часто позволяет снизить дозу леводопы, при необходимости восполнив эффект за счет препаратов других фармакологических групп (агонисты дофаминовых рецепторов, ингибиторы МАО-В, препараты амантадина). Эффект стимулирующих вмешательств при БП может стойко сохраняться в течение многих лет.
Несмотря на то что электростимуляция глубинных структур головного мозга является более безопасной и менее инвазивной методикой по сравнению с деструктивными вмешательствами, тем не менее после нее на том или ином этапе лечения могут возникать осложнения. Их делят на несколько групп:
Осложнения, возникающие во время операции, включают интракраниальные гематомы, пневмоцефа- лию, смещение электрода, эпилептические припадки, дезориентацию, эмболию легочной артерии и др. Частота интракраниальных осложнений по сравнению с деструктивными операциями невысока и составляет в среднем от 1 до 5% [10, 11, 15].
Осложнения, возникающие в послеоперационном периоде: инфекционные осложнения (инфекции кожи, появление эрозий в месте вживления подкожного генератора); технические осложнения, связанные с неточным размещением электрода, его разрывом, смещением нейростимулятора или его неисправностью [6]. Частота инфекционных осложнений составляет от 3 до 10% [10, 15].
Осложнения, связанные с побочными эффектами стимуляции: стимуляционные дискинезии; аксиальные нарушения (дизартрия, постуральная неустойчивость, нарушения ходьбы); сенсорные нарушения в виде парестезий; двигательные нарушения (тоническое сокращение мышц лица или конечностей); вегетативные нарушения в виде ощущения жара, повышенного потоотделения; глазодвигательные нарушения, головокружения, приступы тревоги, эйфории, гипоманий. Эти побочные эффекты проходят при смене электродных контактов или коррекции параметров стимуляции.
Таким образом, электростимуляция глубоких структур мозга является современным, относительно безопасным и эффективным методом лечения БП, способным значительно улучшить качество жизни больного при своевременном направлении на нейрохирургическое вмешательство. В настоящее время продолжается поиск новых точек мишеней (педункулопонтинное ядро, каудальная часть неопределенной зоны [zona incerta]), способных уменьшать рефрактерные к терапии симптомы БП.
После первичного подбора программы нейростимуляции требуются повторные визиты для коррекции программы (примерно от 2 до 5 визитов в первые 6 месяцев), а затем по мере необходимости (примерно 1 раз
в 6-12 мес.) [3]. Несомненно, это привязывает пациентов к специализированным центрам, где работают специалисты, владеющие методикой программирования. До недавнего времени такие специалисты имелись в трех московских учреждениях, однако в последние годы в НИИ нейрохирургии им. Н.Н.Бурденко прошли обучение паркинсонологи из различных регионов России (Казань, Санкт-Петербург, Тюмень и др.), что позволило больным получать квалифицированную помощь независимо от того, где их прооперировали.
Исследование эффективности внутримозговой трансплантации дало неоднозначные результаты. С одной стороны, известны случаи приживления трансплантата и достижения выраженного стойкого улучшения. С другой, у значительной части больных возникли тяжелые, резистентные к терапии дискинезии. В связи с этим данный метод, так же как и методы, основанные на применении стволовых клеток, пока остается экспериментальным.
[1] Центр экстрапирамидных заболеваний, кафедра неврологии РМАНПО.
[2] Научно-исследовательский институт нейрохирургии им. акад. Н.Н.Бурденко.
Литература
- Гамалея А.А., Томский А.А., Бриль Е.В., Шабалов В.А. Электростимуляция глубоких структур головного мозга при экс- трапирамидных заболеваниях. Принципы программирования // Нервные болезни. — 2012. — №4. — С. 55-62.
- Шабалов В.А. Экстрапирамидные расстройства: руководство по диагностике и лечению / Под ред. В.Н.Штока и др. — М.,2002. -С. 552.
- Нллариошкин С.Н. Глубокая электростимуляция головного мозга при экстрапирамидных заболеваниях: взгляд невролога //Нервные болезни. -2011.-1 (4). — С. 2-8.
- Томский А.А., Бриль Е.В., Шабалов В.А., Федорова Н.В. Электростимуляция области субталамического ядра при болезни Паркинсона//Вопр. нейрохир. им. Н.Н.Бурденко. — 2006. — №3. — С. 14-17.
- Ashby Р, Rothwell J.C. Neurophysiologic aspects of deep brain stimulation//Neurology. -2000. — Vol. 55 (Suppl. 6). -P. 17-20.
- Benabid A.L., Pollak P, Louveau A. et al. Combined (thalamotomy and stimulation) stereotactic surgery of VIM thalamic nucleus for bilateral Parkinson’s disease // Appl Neurophysiol. — 1987. — Vol. 50. — P. 344-346.
- L., PollakP, Gross C. et al. Acute and long tenn effects of subthalamic nucleus stimulation in Parkinsons disease // Stereotact Funct Neurosurg. — 1994. — Vol. 62. — P. 76-84.
- Charles P.D., Jan Blercom N.. Krack P. et al. Predictors of effective bilateral subthalamic nucleus stimulation for PD // Neurology. — 2002. — Vol. 59. — P. 932-934.
- Deep brain stimulation for Parkinson’s disease Study Group. Stimulation of the subthalamic nucleus or the pars interna of the globus pallidus in Parkinson’s disease // N Engl J Med. —
- -Vol. 345.-P. 956-963.
- Hamani C., Richer E., Schwab J.AL, Lozano A.AL. Bilateral subthalamic nucleus stimulation for Parkinson’s disease: a systematic review of the clinical literature // — 2005. — Vol. 56. -P. 1313-1321.
- Hariz ALI. Complications of deep brain stimulation surgery // Mov Disord. — 2002. — Vol. 17. — P. 162-166.
- Laitinen L.E, Bergenheim A.T., Hariz ALL Leksell’s postero- ventral pallidotomy in the treatment of Parkinson’s disease // J Neurosurg. — 1992′. — Vol. 76. -P. 53-61.
- Alogilner A.T., Steno D., Rezai A.R. et al. Subthalamic nucleus stimulation in patients with a prior pallidotomy // J Neurosurg. —
- -Vol. 96.-P. 660-665.
- Rodrigues-Oroz Al.C., A Loro E., Krack P. Long-term outcome of surgical therapies for Parkinson’s disease // Mov Disord. — 2012.-Vol. 27, Iss. 14.
- Seijo F.J., Alvarez-Jega ALA., Gutierrez J.C. et al. Complications in subthalamic nucleus stimulation surgery for treatment of Parkinson’s disease. Review of 272 procedures // Acta Neu- rochir. — 2007. — Vol. 149. — P. 867-875.
- A larks IT J. Deep brain stimulation management. — Cambridge University Press, 2011.
- JTeIter AL, Houeto J., Tezenas du ALontcel S. et al. Clinical predictive factors of subthalamic stimulation in Parkinson’s disease // — 2002. — Vol. 125. — P. 575-583.